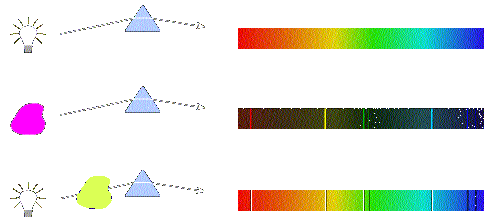
Quando átomos são aquecidos ou submetidos a uma descarga elétrica, eles absorvem energia, que em seguida é emitida como radiação. Por exemplo, se o cloreto de sódio é aquecido na chama de Bunsen, serão produzidos átomos de sódio, que dão origem a uma coloração amarela característica na chama, produzindo linhas espectrais descontínuas em aparelhos específicos. Essa luz emitida pelos átomos podem ser estudadas em espectrômetros, verificando-se que elas são constituídas por linhas com diferentes comprimentos de onda.
O matemático Rydberg, propôs uma equação empírica relacionada às linhas espectrais:
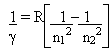
onde R é um valor constante determinado por Rydberg, chamada de constante de Rydberg.
É somente válida para o espectro do hidrogênio a equação acima.
Na época que Rutherford publicou seu modelo já existiam conceitos físicos consagrados e um destes conceitos era a Lei do Eletromagnetismo de Maxwell que dizia: "Toda carga elétrica em movimento acelerado em torno de outra perde energia sob forma de ondas eletromagnéticas". Como o elétron é uma carga elétrica em movimento acelerado em torno do núcleo, perderia energia e se aproximaria do núcleo até chocar-se com este; desta forma o átomo se auto-destruiria.
Em 1913 Bohr afirmou que os fenômenos atômicos não poderiam ser explicados pelas Leis da Física Clássica.
Niels Bohr, dinamarquês, contribuiu para o aperfeiçoamento do modelo atômico de Rutherford. Baseado na teoria quântica, Bohr explicou o comportamento dos elétrons nos átomos. Para Bohr, os elétrons giram em torno do núcleo de forma circular e com diferentes níveis de energia. Seus postulados:
- O átomo possui um núcleo positivo que está rodeado por cargas negativas;
- A eletrosfera está dividida em camadas ou níveis eletrônicos, e os elétrons nessas camadas, apresentam energia constante;
- Em sua camada de origem (camada estacionária) a energia é constante, mas o elétron pode saltar para uma camada mais externa, sendo que, para tal é necessário que ele ganhe energia externa;
- Um elétron que saltou para uma camada de maior energia fica instável e tende a voltar a sua camada de origem; nesta volta ele devolve a mesma quantidade de energia que havia ganho para o salto e emite um fóton de luz.
A energia recebida corresponde a um quantum e é dada por q = h x f
q = energia do quantum h = constante de Planck f = freqüência da radiação
- Para que um elétron permaneça em sua órbita, a atração eletrostática entre o núcleo e o elétron, que tende a puxar o elétron em direção ao núcleo dever ser igual a força centrífuga, que tende a afastar o elétron. Para um elétron de massa m, movendo-se com uma velocidade v numa órbita de raio r, temos que:
Se e for a carga do elétron, Z a carga do núcleo e ε0a permissividade no vácuo, então:

De modo que
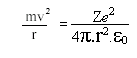
E portanto
De acordo com a teoria quântica de Planck, a energia não é contínua, mas discreta (pacotes de energia). isso significa que a energia de um elétron numa órbita, isto é, seu momento angular mvr, deve ser igual a um número inteiro n de quanta.
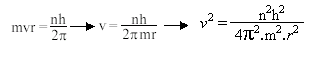
Combinando-se essa equação, com a equação *, temos que
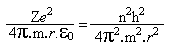
e portanto
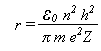
Substituindo o valor das constantes, temos r = 5,292x10-11m, para n = 1. Assim, variando valor de n, teremos uma imagem do átomo de hidrogênio em que o elétron se move em órbitas circulares. O átomo emitirá ou absorverá energia somente ao passar de uma órbita para outra.
Com um pouco de habilidade e paciência, rearranjamos as fórmulas acima e temos:
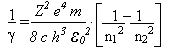
Ou seja, Bohr conseguir obter a empírica equação de Rydberg através de conceitos clássicos e quânticos ao mesmo tempo, onde a constante R de Rydberg é
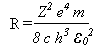
O valor experimental de R é 1,097373x107m-1 em boa concordância com o valor teórico de 1,096776x107m-1. A teoria de Bohr fornece uma explicação para o espectro do hidrogênio. As diferentes séries de linhas espectrais podem ser obtidas variando os valores de n12 e n22 na equação acima.


Nenhum comentário:
Postar um comentário
Comentem essa matéria, mas evitem usar links e escrever palavrões. Obrigado